La determinación de la disposición de los electrones alrededor del nucleo atómico ha sido un inmenso logro de científicos de las Matemáticas, la Física y la Química. Los resultados de las investigaciones muestran aspectos sorprendentes de la naturaleza de la materia y la energía. Estos aspectos, en relación al atomo, permiten fundamentalmente la comprensión del comportamiento químico de las sustancias.
LAS ONDAS ELECTROMAGNETICAS Y LA ENERGÍA
Las ondas electromagnéticas son campos eléctricos (E) y magnéticos (H) variables, oscilantes y mutuamente perpendiculares que se desplazan por el espacio y se relacionan íntimamente con el concepto de energía

Onda electromagnética
MAGNITUDES Y CUALIDADES DE LAS ONDAS
A = Amplitud de la onda (La mayor oscilación respecto de la posición de equilibrio)
c = velocidad de propagación de la onda ( cm/ seg)
l = longitud de onda ( lambda) desplazamiento del frente de onda en un ciclo (cm)
T = Período ( tiempo de un ciclo ) (seg)
n = frecuencia ( nu ) = 1/T seg –1 = ciclos/seg = Hertz
Ecuación fundamental l = c T
_
:. l = c / n :. n = c / l :. n = 1 / l (N° de ondas ) cm -1
Un fenómeno inherente a la naturaleza de las ondas es la interferencia. Es decir, si las ondas se encuentran en fase se suman sus amplitudes, en cambio si las ondas están desfasadas se anulan mutuamente y la amplitud de la onda resultante puede ser nula.
El fenómeno de la difracción de las ondas es una clara manifestación de la propiedad de interferencia de las ondas. Los ribetes de claridad y oscuridad que acompañan la sombra de los bordes de la hoja de afeitar son consecuencia del fenómeno de la difracción y prueban la naturaleza ondulatoria de la luz.
Difracción de la luz
EL ESPECTRO CONTINUO DE ONDAS ELECTROMAGNÉTICAS
Al incidirlas ondas electromagnéticas sobre un prisma es posible separar las componentes según sus distintas frecuencias.
según la FISICA CLASICA
''LA ENERGÍA ERA DE NATURALEZA CONTINUA
Y LA ENERGÍA DE UNA ONDA ELECTROMAGNÉTICA
ERA PROPORCIONAL A LA AMPLITUD DE LA ONDA''.
Algunos experimentos cruciales:
a) El espectro discontinuo de emisión del Hidrógeno

n cm-1
Según Ridberg la frecuencia de las señales está dada por la relación:
n = R H ( 1 / n2 - 1 / m2 ) RH = 109.677 cm –1
n y m enteros
b) El efecto fotoeléctrico.

FÍSICA MODERNA
LA ENERGÍA ES DE CARACTER DISCONTÍNUO
SE PRESENTA A LA FORMA DE PEQUEÑOS
"PAQUETES DE ENERGÍA "
QUE SE DENOMINAN CUANTOS, CUANTAS O FOTONES
LA ENERGÍA DE UNA ONDA ELECTROMAGNÉTICA ES PROPORCIONAL A SU FRECUENCIA
ECUACIÓN DE MAX PLANCK
ENERGÍA DE UN FOTÓN = h n
h = Constante de Planck = 6,62 10 -27 erg. seg
(Principios Básicos de Química H.Gray)
1) Orbitas circulares
2) Momento angular = m e v r = n h / 2 p n = 1,2,3...........a

Ciertos valores de r Ciertos valores de E
u órbitas permitidas o niveles de energía permitidos
Energía asociada a los cambios de órbita
La formula anterior dá la frecuencia de los fotónes emitidos ( expresadas en Número de Ondas) para las transiciones de electrónicas de pérdida de energía en el átomo de Hidrógeno. Esta fórmula deducida a partir de consideraciones de discontinuidad de la energía ( Física Moderna) está en excelente acuerdo con la ecuación de Ridberg para el espectro discontinuo de emisión del átomo de Hidrógeno. Esta coincidencia en las expresiones fué un éxito para los postulados acerca de la energía de la Física Moderna y para el modelo atómico de Bohr. Sin embargo nuevos experimentos mostraron aspectos insatifactorios y la necesidad de otros modelos y explicaciones.
LA MECANICA CUANTICA ONDULATORIA
Efecto Compton

DUALISMO ONDA- PARTÍCULA
FOTÓN = ONDA EFECTO
COMPTON
==>
PARTÍCULA
ELECTRÓN = PARTÍCULA DIFRACCIÓN
DE
ELECTRONES
(1927)
==>
ONDA
DE BROGLIE " Todo cuerpo en movimiento tiene una onda asociada"
λ = h / m x v = h / p
Electrón, partícula – onda estacionaria .
PRINCIPIO DE INCERTIDUMBRE DE HEISSENBERG
Es imposible conocer simultáneamente la posición x y el momento p de un electrón
D x D p = l . h / l = h > 0
ECUACION ONDA PARTÍCULA DE SCHRODINGER
Ecuación diferencial de 2° orden para sistemas onda partícula, en tres dimensiones e independiente del tiempo donde:
h = constante de Planck,
y = Amplitud de la onda,
m = masa dela partícula
x,y,z = coordenadas de posición,
V(x,y,z ) = Energía Potencial,
E = Energía de la partícula
Resolver la ecuación es, lograr por integración, expresiones para:
y = f (x,y,z) ; E = g (x,y,z)
y 2 a Probabilidad de encontrar la partícula en x,y,z
El encontrar, mediante el cálculo, las zonas de alta probabilidad de encontrar la partícula equivale a determinar los orbitales.
ORBITAL
ZONA DE ALTA PROBABILIDAD DE ENCONTRAR UNA PARTÍCULA
La Ecuación de Schorodinger se aplica al átomo de Hidrógeno y se resuelve obteniendo expresiones para y y E del tipo trigonométricas. En estas expresiones aparecen los denominados números cuánticos n, l, y m cuyas combinaciones se asocian a zonas de alta probabilidad de encontrar el electrón u orbitales.
LOS NUMEROS CUANTICOS, SU SIGNIFICADO,
SUS VALORES Y REGLAS DE COMBINACIÓN
n = Número cuántico principal.
Se asocia al tamaño y energia de los orbitales
¿Cuántos valores? infinito
¿Cuáles? 1,2 3,4,..............a ( Es el mismo n del átomo de Bohr)
l = Número cuántico secundario
Se asocia al tipo o forma de los orbitales
¿Cuántos valores? n
¿Cuáles? 0, 1, 2, 3, .........(n-1)
s p d f
Cada uno de los cuatro primeros valores se asocian respectivamente a las letras que se indican.
m = Numero cuántico magnético.
Se asocia con la orientación espacial de los orbitales
¿Cuántos valores? 2l +1
¿Cuáles? - l, - ( l-1 ), .... -1, 0, 1, ......+ ( l-1 ), + l
s = Numero cuántico de spín electrónico.
Se asocia al giro del electrón sobre su eje
¿Cuántos valores? 2
¿Cuáles? - 1 / 2 , + 1 / 2
COMBINACIONES DE NUMEROS CUANTICOS Y LOS ORBITALES
n l m nl Número de Orbitales
1 0 0 1s 1
2 0 0 2s 1
1 - 1 2px 3
0 2py
1 2pz
3 0 0 3 1
1 -1 3px 3
0 3py
1 3pz
2 - 2 3d 5
-1 3d
0 3d
1 3d
2 3d
4 0 0 4s 1
1 -1 4px 3
0 4py
1 4pz
2 - 2 4d 5
- 1 4d
0 4d
1 4d
2 4d
3 - 3 4f 7
- 2 4f
- 1 4f
0 4f
1 4f
2 4f
3 4f
Se le sugiere construir el cuadro de combinaciones para n = 5
GRÁFICOS DE ORBITALES
Los orbitales px , py y pz
Los 5 orbitales d
Los 7 orbitales f
ATOMOS POLIELECTRÓNICOS
Ante la imposibilidad de resolver la ecuación de Schorodinger para sistemas de varios electrones, se ha supuesto y con éxito, que sucesivos electrones adoptarán los diversos modos de vibración que se encontraron para el electrón de átomo de Hidrógeno.
En palabras más simples, los sucesivos electrones se ubicaran en los orbitales ya determinados para el átomo de Hidrógeno y de acuerdo a las siguientes reglas.
Principio de exclusión de Pauli
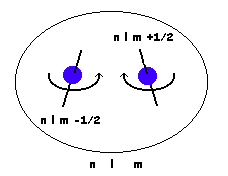
No puede haber 2 electrones con los 4 números cuánticos iguales. Es equivalente a establecer que un orbital acepta un máximo de 2 electrones.
Principio de Estabilidad o menor Energía
Regla de Ta o de las diagonales.
Los electrones se ubican primero en los orbitales de menor energía.
Son de menor energía los de menor valor de n + l.
A igualdad de n + l se considera de menor energía los de menor n.

Diagonales indican el orden de llenado ( energía creciente)
Principio de Hund
En el caso de varios orbitales de igual energía o "degenerados" ( igual n + l , igual n ), por ejemplo una serie de 3 orbitales p, o una serie de 5 orbitales d, o bién una de7 orbitales f. Los electrones entran de a uno en cada uno de ellos, haciéndolo primero, por convención, con spin negativo. Cuando todos los orbitales " degenerados" ya hayan recibido un electrón con spin negativo pueden formarse parejas de spines opuestos.
PROPIEDADES MAGNETICAS DE LAS SUSTANCIAS
Parece conveniente indicar en este momento que el principio de Hund promueve la situación que existan orbitales con un sólo electrón o electrón desapareado. Esta circunstancia tiene una importante consecuencia en las propiedades magnéticas de los elementos. Aquellas sustancias que poseen orbitales con electrones desapareados ( spin - 1/2) tienen propiedades paramagnéticas, esto es, los campos magnéticos de spín se suman, refuerzan o atraen los campos magnéticos externos, las sustancia son imantables.
De no suceder así, es decir, si todos los orbitales tienen electrones apareados ( spin + 1/2 y - 1/2 ) es una circunstancia que determina el diamagnetismo, la sustancia repele campos magnéticos externos y las sustancias no son imantables.
GRAFICO RESUMEN

Diagrama para llenado electrónico, orbitales disponibles y en orden de energía creciente
CONFIGURACIONES ELECTRÓNICAS Y ELECTRONES DE VALENCIA

Los electrones de valencia son aquellos que se encuentran en los orbitales de mayor número cuántico principal más aquellos que están en orbitales con el número cuántico principal anterior al mayor a condición de estar incompletos.
SISTEMA PERIODICO DE LOS ELEMENTOS
Ubicación de los Números Atómicos por Configuraciones Electrónicas

¿ Cuál es la configuración electrónica detallada del elemento cuyo Z = 77 ?
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 5d2 5d1 5d1 5d1
¿Cuales son electrones de valencia?
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 5d2 5d1 5d1 5d1
¿Cuales son los números cuánticos del último electrón ?
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d!¡ 5d!¡ 5d! 5d! 5d!
n= 5 l =2 m= -1 s = + 1


PROPIEDADES PERIODICAS DE LOS ELEMENTOS
La repetición de las configuraciones electrónicas y la consiguiente conformación de un sistema de períodos y grupos es el fenómeno de carácter periódico más relevante. Sin embargo, hay otras propiedades atómicas importantes afectadas de carácter periódico.
No hay comentarios:
Publicar un comentario