El enlace químico es la fuerza que une a los atomos para formar las moléculas.
Como ya se ha dicho es un proceso de estabilización por interacciones electrónicas donde cada átomo trata de alcanzar la configuración electrónica del gas noble más cercano. Por lo general los gases nobles tienen 8 electrones de valencia, de allí se acostumbra a decir que el enlace químico se forma cumpliendo la "regla del octeto".
La energía de estabilización se denomina también la energía de enlace y corresponde además de la energía liberada cuando se forma el enlace a la energía necesaria para romper el enlace.

Aquí es conveniente repasar el concepto de electrones de valencia y su representación mediante la notación de Lewis.
Los electrones de valencia son aquellos que se encuentran en los orbitales de mayor número cuántico principal más aquellos que están en orbitales con el número cuántico principal anterior al mayor a condición de estar incompletos.

TIPOS DE ENLACES Y POLARIDAD DE LOS ENLACES
Existen dos mecanismos para cumplir la regla del octeto.
1.ENLACE IONICO. Cesión de electrones, de parte de un átomo fuertemente electropositivo a otro fuertemente electronegativo. Formación de iones positivos y negativos y atracción electrostática entre ellos.
2.ENLACE COVALENTE. Compartición de parejas de electrones entre átomos de parecida o igual electronegatividad. Electrones compartidos con spines opuestos y atracción magnética.
Ejemplos de estas situaciones, donde se muestra la estructura electrónica a nivel molecular, se dan a continuación mediante las correspondientes notaciones de Lewis.

En la segunda parte de gráfico precedente se muestra como un enlace covalente deviene en covalente polar y luego en iónico polar simplemente al crecer la asimetría de la posición de la pareja de electrones compartida.
A continuación una visión total, o sea las diferentes situaciones en función de la diferencia de electronegatividad entre los átomos involucrados.
PARA UN CURSO DE QUIMICA ORGANICA
ENLACE COVALENTE DATIVO Y CARGAS FORMALES
Se presenta con relativa frecuencia la situación que para formar un enlace covalente o de compartición, es uno de los átomos participantes del enlace el que aporta la pareja de electrones del enlace. El enlace que se forma se llama covalente dativo y va acompañado de desbalances de cargas eléctricas que deben ser determinados para tener una clara visión de la situación molecular.
Los desbalances de cargas eléctricas se detectan mediante el cálculo de las cargas formales haciendo uso de la siguiente relación:
CF = N° de electrones de valencia - ( N° electrones no enlazantes + 1/2 N° electrones enlazantes )
LA RESONANCIA ELECTRÓNICA
" Cuando para una molécula se puede escribir varias varias configuraciones de Lewis correctas ( sin cambiar de posición los átomos) , la verdadera configuración es una mezcla de todas ellas que se denomina hibrido de resonancia y dónde la importancia de cada estructura contribuyente es proporcional a sus estabilidad."
Ejemplo: el dióxido de carbono
Los porcentajes de contribución al híbrido en este caso son estimativos y se entregan sólo a forma de ilustración.
Otro ejemplo: el ión carbonato
En este caso la contribución es la misma pues las estructuras son equivalentes desde el punto de vista de la energía. Se ha demostrado por la técnica de difracción de los rayos x, que las distancias entre el carbono y los oxígenos es siempre la misma y corresponde a un valor intermedio entre la longitud de un enlace simple y uno doble.
Reglas de la resonancia electrónica
1).- Al escribir estructuras resonantes se desplazan electrones y nunca átomos.
2).- Todas las formas resonantes del híbrido deben tener el mismo número de electrones apareados.
3).- Las estructuras con mayor número de enlaces son más contribuyentes. La estructuras con cargas eléctricas son menos contribuyentes.
4).- Las estructuras con carga negativa en el átomo más electronegativo son más contribuyentes que aquellas que tienen la carga negativa en el átomo menos electronegativo.
5).- Las estructuras con cargas de distinto signo más próximas, son más contribuyentes.
6).- Las estructuras con cargas de igual signo muy próximas, tienen poca contribución.
Ejemplo: Formas resonantes del propenaldehído en fórmulas abreviadas
La I es la más estable ( Regla 3 y 6)
La VI es la más inestable ( Regla 3)
La II y III son más estables que IV y V ( Regla 4)
La II es más estable que la III ( Regla 5 )
La IVs más estable que la V ( Regla 5 )
EL ENLACE QUÍMICO Y LA MECANICA CUANTICA
La Mecánica Cuántica contempla la combinación matemática de las funciones de ondas de orbitales atómicos para dar orbitales moleculares ( pertenecen a la molécula). La combinación produce dos orbitales moleculares.
ENERGÍA DE LOS ORBITALES MOLECULARES ENLAZANTES Y ANTIENLAZANTES EN FUNCIÓN DE LA DISTANCIA INTERATÓMICA
La suma de funciones atómicas da un orbital molecular enlazante donde se sitúa la pareja de electrones con spines opuestos . Este se puede visualizar como la superposición de los orbitales atómicos. En el grafico siguiente se muestra la energía de éste orbital molecular en función de la distancia internuclear. Existe una estabilización a medida que los átomos se acercan pues predominan las fuerzas de atracción entre los atomos sin embargo si los átomos se acercan demasiado hay una desestabilización producto de fuerzas de repulsión interatómica. La menor energía corresponde a un pozo de energía en que se encuentran los átomos en equilibrio respecto de las atracción y la repulsión interatómicas. Este pozo de energía determina la distancia internuclear llamada también longitud de enlace.
La diferencia de funciones atómicas genera un orbital molecular antienlazante marcado por fuerzas de repulsión en donde la la mayor estabilidad se alcanza cuando los átomós están separados a gran distancia. En este orbital los electrones se encuentran con spines paralelos. Corrresponde al proceso de ruptura d el enlace.

CUADRO COMPARATIVO DE ENERGÍAS Y LONGITUDES DE ENLACE
ENLACES C-C C = C H - H C - H C - O C = O
ENERGÍAS DE ENLACE Kcal/mol 83 146 200 104 99 85 179
LONGITUDES DE ENLACE A° 1,54 1,35 1,2 1,07 1,43 1,22
TIPOS DE UNIONES
Los gráficos siguientes además de reforzar los conceptos de orbitales moleculares enlazantes y antienlazantes y sus implicancias desde el punto de vista de la energía nos muestran dos situaciones que apuntan más bién al tipo de orbitales que intervienen o a distintas formas de unión.

Combinación de orbitales atómic
Unión s (sigma)
Orbital Molecular enlazante con superposición de orbitales atómicos sobre linea internuclear
Combinación de orbitales atómicos p.

Unión p (pi)
Orbital Molecular Enlazante con superposición de orbitales atómicos fuera de linea internuclear.
TIPOS DE ENLACES Y UNIONES
CUADRO COMPARATIVO DE ENERGÍAS Y LONGITUDES DE ENLACE
ENLACES C-C C = C H - H C - H C - O C = O
ENERGÍAS DE ENLACE Kcal/mol 83 146 200 104 99 85 179
LONGITUDES DE ENLACE A° 1,54 1,35 1,2 1,07 1,43 1,22
GEOMETRÍA MOLECULAR
LA HIBRIDACIÓN DE ORBITALES
La disposición de los átomos en el espacio se determina experimentalmente mediante la técnica de difracción de rayos X. Para hacer concordar la información experimental con aspectos teóricos se ha visto la necesidad de formular un modelo de reordenamiento posicional de los orbitales atómicos. Esta formulación de orden matemático se conoce como hibridación de los orbitales atómicos (mezcla matemática de funciones de onda).
Existen diferentes formas de hibridación y la forma que en definitiva adopte un átomo decidirá la orientación espacial de sus orbitales y por consecuencia la GEOMETRIA MOLECULAR .
Unidad 6
PROPIEDADES FISICOQUIMICAS
DE LAS SUSTANCIAS PURAS
Los tipos de enlaces, la direccionalidad de éstos, los rasgos eléctricos y otras características moleculares determinan las propiedades fisicoquímicas de las sustancias.
Parece conveniente referirse en éste momento a la fortaleza comparada de los distintos tipos de enlaces interatómicos. La fortaleza del enlace está dada por la energía necesaria para romper el enlace y ésta a su vez es directamente proporcional a la energía de estabilización o energía liberada cuando el enlace se forma.
El enlace covalente es el más fuerte, lo sigue el iónico y finalmente el metálico que es el más débil.

A continuación trataremos de visualizar las distintas categorías de sustancias y sus propiedades fisicoquímicas principales.
MOLECULAS GIGANTES
Son arreglos de átomos, unidos mediante fuerzas de enlace químico (interatómico), en que no está definido el tamaño del sistema. Por lo general son arreglos de gran tamaño y de allí el nombre de la categoría. La proporción de distintos átomos se conoce y se representan estos sistemas por su fórmula empírica. La fórmula verdadera es (F.E.) n , pero n es indeterminada.
Hay tres grandes tipos de moléculas gigantes, las de enlace iónico, las de enlace covalente y las de enlace metálico.
COVALENTES TRIDIMENSIONALES
Son arreglos tridimensionales de átomos iguales o diferentes unidos por enlaces covalentes y dispuestos en el espacio siguiendo las reglas de la hibridación. Son las estructuras más rígidas, duras o resistentes que se conocen.
Sus temperaturas de fusión son muy altas ( miles de°C) y en muchos casos se descomponen químicamente por el calor antes de entrar en fusión. Por otra parte la separación de las partículas por acción de moléculas de un solvente es imposible, por lo tanto son completamente insolubles.
El Carbono en su forma de diamante ( hibridación sp3 ) es un ejemplo típico de ésta categoría. Las láminas de Silicio de la nariz del Discovery son otro ejemplo.

COVALENTES BIDIMENSIONALES
Es cuando la red de enlaces covalentes se teje en dos dimensiones. Los mismos conceptos de infusibilidad e insolubilidad que para las mallas trididimensionales pero no así en lo que se refiere a la dureza pues las fuerzas de atracción entre las mallas bidimensionales es débil. Por esa razón estas sustancias son blandas en el sentido del desprendimiento de las mallas.
El ejemplo típico es el Carbono en su forma de grafito en que los C están hibridizados sp2 . Es interesante consignar que en cada orbital pz existen un electrón. Estos electrones se pueden desplazar sobre la malla y en consecuencia el grafito es conductor de la corriente eléctrica.
COVALENTES UNIDIMENSIONALES
Corresponde a las sustancias denominadas polímeros, largas cadenas de unidades conectadas por enlaces covalentes.
Los homopolímeros que repiten unidades iguales (-A-A-A-A-A-A- ; -(A)- n ).
Los copolímeros que repiten unidades distintas ( A-B-A-B-A-B- ; ( -A-B-) n ).
Son cadenas largas llamadas también macromoléculas y por ésta razón es que interaccionan unas con otras de manera significativa. Las interacciones entre macromoléculas son fuerzas de distintos tipos y que veremos más adelante en el caso de moléculas pequeñas.
En los polímeros, en primer término, la fusión y la solubilización están determinadas por la magnitud de las fuerzas de atracción entre las macromoléculas, en principio altas, precisamente por la longitud de las cadenas. Sin embargo, existe un segundo factor determinante, el factor entrópico o desorden que pueden alcanzar las estructuras una vez solubilizadas o fundidas.
Los polímeros flexibles o plegables forman estructuras sólidas bifásicas (cristalinas – amorfas) que son quebradizas, éstas estructuras se pueden disolver o fundir con relativa facilidad pues cuando alcanzan tales estados la macromoléculas están muy enroscadas, plegadas u ovilladas, en suma desordenadas lo que favorece el proceso de separación de las macromoléculas.

En cambio, las macromoléculas rígidas no tienen favorable el factor entrópico y así son dificiles de fundir y solubilizar. Estos polímeros rígidos, en el sólido son monofásicos y de mucha resistencia ( Kevlar).

En la práctica un gran número de macromoléculas se encuentran entre estas dos situaciones extremas y el grado de endurecimiento o ablandamiento depende de las temperaturas a que se encuentran sometidos los sistemas.
Los procesos de ablandamiento sobrevienen en zonas de temperaturas bien definidas para cada tipo de macromoléculas.
Muchas veces las cadenas macromoléculares sintéticas o naturales se conectan entre sí mediante átomos o grupos de átomos enlazados covalentemente ( polímeros reticulados) con propósitos tecnológicos precisos. En estos casos las estructuras resultantes semejan a las redes covalentes bi o tridimensionales y así también son sus propiedades, nula solubilidad y puntos de fusión demasiado elevados que amenazan la estabilidad química de las sustancias.

Copolímero de estireno-butadieno (neumáticos) vulcanizado con S.
Este tipo de productos son difíciles de recuperar y reutilizar ( Reciclaje) precisamente por las razones ya mencionadas y constituyen un problema para la ecología por la contaminación del ambiente.
La celulosa es un polímero natural de características estructurales semirígidas y si a ello agregamos que entre las cadenas macromoleculares existen fuerzas de atracción, de alta magnitud como los puentes de H debido a la presencia de mucho grupos de -OH son comprensibles las dificultades para la fusión y la solubilización.
Estructura tipo celulosa
IONICAS.
En estas moléculas gigantes los átomos están unidos por enlaces iónicos. Es decir son un arreglo de iones positivos y negativos que se disponen alternadamente en el espacio compensando sus cargas . La geometría del arreglo es simple cuando los iones positivos y negativos son monoatómicos y además se encuentran en relación 1:1 como en el caso del Na+Cl -. Cuando los iones son complejos, con grandes diferencias de tamaños o la proporción entre ellos no es simple, los arreglos son complicados y son materia de estudio de la Cristalografía que hace uso de las técnicas de difracción de rayos X para resolver estas situaciones.

Son estructuras de temperatura de fusión elevadas , alrededor de los 1000°C de acuerdo a la fortaleza del enlace iónico. En estado sólido o cristalino, donde los iones se encuentran atrapados no conduce la corriente eléctrica, pero sí la conducen en estado fundido.
Estas estructuras pueden ser solubilizadas, aunque no siempre, mediante solventes con moléculas polares como el caso de agua. Las moléculas del solvente rodean los iones apuntando sus fracciones de carga al ión de carga opuesta. Así los iones solvatados son separados al debilitarse el enlace iónico. De ésta forma los iones disueltos (móviles) constituyen partículas para el flujo eléctrico.
METALICAS
Corresponde al caso de los metales. Los átomos metálicos , al ser muy electropositivos se desprenden de sus electrones de valencia pasando a formar iones positivos. Por su parte los electrones que han perdido su pertenencia a un átomo determinado se mueven entre los iones constituyendo una nube de electrones delocalizados. Esta nube de electrones que une a iones positivos es el enlace metálico.
Ya nos hemos referido a la fortaleza del enlace metálico y podemos generalizar diciendo que los puntos de fusión de los metales son medianamente altos. Señalemos que metales como el Hg, Cs, y Fr son líquidos a temperatura ambiente.
La naturaleza de movilidad del enlace metálico confiere a los metales su blandura, es decir los convierte en dúctiles y maleables.
La movilidad de los electrones se traduce en la capacidad de conducción de la corriente eléctrica y también es responsable de la conductividad térmica.
Es interesante observar la relación entre las conductividades eléctricas y térmicas y la situación de los diagramas de energía de los orbitales llenos y vacíos de metales y no metales. Los metales promueven sus electrones de valencia de orbitales s a los orbitales p vacíos que se encuentran energéticamente cercanos formando éstos últimos orbitales o bandas de conducción. Por el contrario, los no metales tienen los electrones en orbitales p y los orbitales s siguientes vacíos se encuentran energéticamente lejanos por lo que no se produce la promoción y los electrones permanecen ligados a sus respectivos átomos.

MOLECULAS CONVENCIONALES
O SUSTANCIAS MOLECULARES
Son aquellos sistemas formados por moléculas que se encuentran claramente definidas, se conoce el número exacto de átomos y de qué elementos está constituída la molécula. Se representan por las llamadas fórmulas moleculares reales.
En su gran mayoría las moléculas de ésta categoría unen sus átomos con enlaces covalentes y al expresar esto pensamos en muchas moléculas simples formadas entre no metales y en la inmensa cantidad de compuestos orgánicos constituídos principalmente por los elementos C, H, O, N, P, S.
Sin embargo al momento de racionalizar las propiedades fisicoquímicas de este tipo de estructuras, el tipo de enlace interatómico ( covalente) y su fortaleza no cuenta pués en este caso lo determinante son las fuerzas entre moléculas o fuerzas intermoleculares y en algunos casos son fuerzas intramoleculares ( fuerzas dentro de las moléculas; pero no interatómicas o de enlace químico ) las determinantes de las propiedades.
En todo caso las fuerzas intermoleculares son de naturaleza eléctrica, pero las hay de diferente naturaleza y magnitudes pero siempre dependen en definitiva de las características eléctricas, del tamaño y geometría de las moléculas.
En los comentarios generales cabe señalar que estos sistemas no conducen la corriente eléctrica en ningún estado físico y también son malos conductores del calor.
martes 18 de mayo de 2010
Unidad 3 y 4
La determinación de la disposición de los electrones alrededor del nucleo atómico ha sido un inmenso logro de científicos de las Matemáticas, la Física y la Química. Los resultados de las investigaciones muestran aspectos sorprendentes de la naturaleza de la materia y la energía. Estos aspectos, en relación al atomo, permiten fundamentalmente la comprensión del comportamiento químico de las sustancias.
LAS ONDAS ELECTROMAGNETICAS Y LA ENERGÍA
Las ondas electromagnéticas son campos eléctricos (E) y magnéticos (H) variables, oscilantes y mutuamente perpendiculares que se desplazan por el espacio y se relacionan íntimamente con el concepto de energía

Onda electromagnética
MAGNITUDES Y CUALIDADES DE LAS ONDAS
A = Amplitud de la onda (La mayor oscilación respecto de la posición de equilibrio)
c = velocidad de propagación de la onda ( cm/ seg)
l = longitud de onda ( lambda) desplazamiento del frente de onda en un ciclo (cm)
T = Período ( tiempo de un ciclo ) (seg)
n = frecuencia ( nu ) = 1/T seg –1 = ciclos/seg = Hertz
Ecuación fundamental l = c T
_
:. l = c / n :. n = c / l :. n = 1 / l (N° de ondas ) cm -1
Un fenómeno inherente a la naturaleza de las ondas es la interferencia. Es decir, si las ondas se encuentran en fase se suman sus amplitudes, en cambio si las ondas están desfasadas se anulan mutuamente y la amplitud de la onda resultante puede ser nula.
El fenómeno de la difracción de las ondas es una clara manifestación de la propiedad de interferencia de las ondas. Los ribetes de claridad y oscuridad que acompañan la sombra de los bordes de la hoja de afeitar son consecuencia del fenómeno de la difracción y prueban la naturaleza ondulatoria de la luz.
Difracción de la luz
EL ESPECTRO CONTINUO DE ONDAS ELECTROMAGNÉTICAS
Al incidirlas ondas electromagnéticas sobre un prisma es posible separar las componentes según sus distintas frecuencias.
según la FISICA CLASICA
''LA ENERGÍA ERA DE NATURALEZA CONTINUA
Y LA ENERGÍA DE UNA ONDA ELECTROMAGNÉTICA
ERA PROPORCIONAL A LA AMPLITUD DE LA ONDA''.
Algunos experimentos cruciales:
a) El espectro discontinuo de emisión del Hidrógeno

n cm-1
Según Ridberg la frecuencia de las señales está dada por la relación:
n = R H ( 1 / n2 - 1 / m2 ) RH = 109.677 cm –1
n y m enteros
b) El efecto fotoeléctrico.

FÍSICA MODERNA
LA ENERGÍA ES DE CARACTER DISCONTÍNUO
SE PRESENTA A LA FORMA DE PEQUEÑOS
"PAQUETES DE ENERGÍA "
QUE SE DENOMINAN CUANTOS, CUANTAS O FOTONES
LA ENERGÍA DE UNA ONDA ELECTROMAGNÉTICA ES PROPORCIONAL A SU FRECUENCIA
ECUACIÓN DE MAX PLANCK
ENERGÍA DE UN FOTÓN = h n
h = Constante de Planck = 6,62 10 -27 erg. seg
(Principios Básicos de Química H.Gray)
1) Orbitas circulares
2) Momento angular = m e v r = n h / 2 p n = 1,2,3...........a

Ciertos valores de r Ciertos valores de E
u órbitas permitidas o niveles de energía permitidos
Energía asociada a los cambios de órbita
La formula anterior dá la frecuencia de los fotónes emitidos ( expresadas en Número de Ondas) para las transiciones de electrónicas de pérdida de energía en el átomo de Hidrógeno. Esta fórmula deducida a partir de consideraciones de discontinuidad de la energía ( Física Moderna) está en excelente acuerdo con la ecuación de Ridberg para el espectro discontinuo de emisión del átomo de Hidrógeno. Esta coincidencia en las expresiones fué un éxito para los postulados acerca de la energía de la Física Moderna y para el modelo atómico de Bohr. Sin embargo nuevos experimentos mostraron aspectos insatifactorios y la necesidad de otros modelos y explicaciones.
LA MECANICA CUANTICA ONDULATORIA
Efecto Compton

DUALISMO ONDA- PARTÍCULA
FOTÓN = ONDA EFECTO
COMPTON
==>
PARTÍCULA
ELECTRÓN = PARTÍCULA DIFRACCIÓN
DE
ELECTRONES
(1927)
==>
ONDA
DE BROGLIE " Todo cuerpo en movimiento tiene una onda asociada"
λ = h / m x v = h / p
Electrón, partícula – onda estacionaria .
PRINCIPIO DE INCERTIDUMBRE DE HEISSENBERG
Es imposible conocer simultáneamente la posición x y el momento p de un electrón
D x D p = l . h / l = h > 0
ECUACION ONDA PARTÍCULA DE SCHRODINGER
Ecuación diferencial de 2° orden para sistemas onda partícula, en tres dimensiones e independiente del tiempo donde:
h = constante de Planck,
y = Amplitud de la onda,
m = masa dela partícula
x,y,z = coordenadas de posición,
V(x,y,z ) = Energía Potencial,
E = Energía de la partícula
Resolver la ecuación es, lograr por integración, expresiones para:
y = f (x,y,z) ; E = g (x,y,z)
y 2 a Probabilidad de encontrar la partícula en x,y,z
El encontrar, mediante el cálculo, las zonas de alta probabilidad de encontrar la partícula equivale a determinar los orbitales.
ORBITAL
ZONA DE ALTA PROBABILIDAD DE ENCONTRAR UNA PARTÍCULA
La Ecuación de Schorodinger se aplica al átomo de Hidrógeno y se resuelve obteniendo expresiones para y y E del tipo trigonométricas. En estas expresiones aparecen los denominados números cuánticos n, l, y m cuyas combinaciones se asocian a zonas de alta probabilidad de encontrar el electrón u orbitales.
LOS NUMEROS CUANTICOS, SU SIGNIFICADO,
SUS VALORES Y REGLAS DE COMBINACIÓN
n = Número cuántico principal.
Se asocia al tamaño y energia de los orbitales
¿Cuántos valores? infinito
¿Cuáles? 1,2 3,4,..............a ( Es el mismo n del átomo de Bohr)
l = Número cuántico secundario
Se asocia al tipo o forma de los orbitales
¿Cuántos valores? n
¿Cuáles? 0, 1, 2, 3, .........(n-1)
s p d f
Cada uno de los cuatro primeros valores se asocian respectivamente a las letras que se indican.
m = Numero cuántico magnético.
Se asocia con la orientación espacial de los orbitales
¿Cuántos valores? 2l +1
¿Cuáles? - l, - ( l-1 ), .... -1, 0, 1, ......+ ( l-1 ), + l
s = Numero cuántico de spín electrónico.
Se asocia al giro del electrón sobre su eje
¿Cuántos valores? 2
¿Cuáles? - 1 / 2 , + 1 / 2
COMBINACIONES DE NUMEROS CUANTICOS Y LOS ORBITALES
n l m nl Número de Orbitales
1 0 0 1s 1
2 0 0 2s 1
1 - 1 2px 3
0 2py
1 2pz
3 0 0 3 1
1 -1 3px 3
0 3py
1 3pz
2 - 2 3d 5
-1 3d
0 3d
1 3d
2 3d
4 0 0 4s 1
1 -1 4px 3
0 4py
1 4pz
2 - 2 4d 5
- 1 4d
0 4d
1 4d
2 4d
3 - 3 4f 7
- 2 4f
- 1 4f
0 4f
1 4f
2 4f
3 4f
Se le sugiere construir el cuadro de combinaciones para n = 5
GRÁFICOS DE ORBITALES
Los orbitales px , py y pz
Los 5 orbitales d
Los 7 orbitales f
ATOMOS POLIELECTRÓNICOS
Ante la imposibilidad de resolver la ecuación de Schorodinger para sistemas de varios electrones, se ha supuesto y con éxito, que sucesivos electrones adoptarán los diversos modos de vibración que se encontraron para el electrón de átomo de Hidrógeno.
En palabras más simples, los sucesivos electrones se ubicaran en los orbitales ya determinados para el átomo de Hidrógeno y de acuerdo a las siguientes reglas.
Principio de exclusión de Pauli
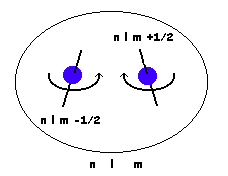
No puede haber 2 electrones con los 4 números cuánticos iguales. Es equivalente a establecer que un orbital acepta un máximo de 2 electrones.
Principio de Estabilidad o menor Energía
Regla de Ta o de las diagonales.
Los electrones se ubican primero en los orbitales de menor energía.
Son de menor energía los de menor valor de n + l.
A igualdad de n + l se considera de menor energía los de menor n.

Diagonales indican el orden de llenado ( energía creciente)
Principio de Hund
En el caso de varios orbitales de igual energía o "degenerados" ( igual n + l , igual n ), por ejemplo una serie de 3 orbitales p, o una serie de 5 orbitales d, o bién una de7 orbitales f. Los electrones entran de a uno en cada uno de ellos, haciéndolo primero, por convención, con spin negativo. Cuando todos los orbitales " degenerados" ya hayan recibido un electrón con spin negativo pueden formarse parejas de spines opuestos.
PROPIEDADES MAGNETICAS DE LAS SUSTANCIAS
Parece conveniente indicar en este momento que el principio de Hund promueve la situación que existan orbitales con un sólo electrón o electrón desapareado. Esta circunstancia tiene una importante consecuencia en las propiedades magnéticas de los elementos. Aquellas sustancias que poseen orbitales con electrones desapareados ( spin - 1/2) tienen propiedades paramagnéticas, esto es, los campos magnéticos de spín se suman, refuerzan o atraen los campos magnéticos externos, las sustancia son imantables.
De no suceder así, es decir, si todos los orbitales tienen electrones apareados ( spin + 1/2 y - 1/2 ) es una circunstancia que determina el diamagnetismo, la sustancia repele campos magnéticos externos y las sustancias no son imantables.
GRAFICO RESUMEN

Diagrama para llenado electrónico, orbitales disponibles y en orden de energía creciente
CONFIGURACIONES ELECTRÓNICAS Y ELECTRONES DE VALENCIA

Los electrones de valencia son aquellos que se encuentran en los orbitales de mayor número cuántico principal más aquellos que están en orbitales con el número cuántico principal anterior al mayor a condición de estar incompletos.
SISTEMA PERIODICO DE LOS ELEMENTOS
Ubicación de los Números Atómicos por Configuraciones Electrónicas

¿ Cuál es la configuración electrónica detallada del elemento cuyo Z = 77 ?
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 5d2 5d1 5d1 5d1
¿Cuales son electrones de valencia?
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 5d2 5d1 5d1 5d1
¿Cuales son los números cuánticos del último electrón ?
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d!¡ 5d!¡ 5d! 5d! 5d!
n= 5 l =2 m= -1 s = + 1


PROPIEDADES PERIODICAS DE LOS ELEMENTOS
La repetición de las configuraciones electrónicas y la consiguiente conformación de un sistema de períodos y grupos es el fenómeno de carácter periódico más relevante. Sin embargo, hay otras propiedades atómicas importantes afectadas de carácter periódico.
No hay comentarios:
Publicar un comentario